קטגוריות: מאמרים מוצגים » חשמלאים מתחילים
מספר צפיות: 36288
הערות לכתבה: 1
מקורות זרם כימי: מאפיינים עיקריים
 במשך יותר משתי מאות שנים האנושות משתמשת באנרגיה של תגובות כימיות בין חומרים שונים כדי לייצר זרם ישר.
במשך יותר משתי מאות שנים האנושות משתמשת באנרגיה של תגובות כימיות בין חומרים שונים כדי לייצר זרם ישר.
עקרון עבודה
תגובת הרדוקס המתרחשת בין חומרים בעלי תכונות של חומר מחמצן וחומר מקטין מלווה בשחרור אלקטרונים שתנועתם יוצרת זרם חשמלי. עם זאת, על מנת להשתמש באנרגיה שלה, יש צורך ליצור תנאים למעבר אלקטרונים דרך מעגל חיצוני, אחרת הוא משתחרר לסביבה החיצונית על ידי פשוט ערבוב של חומר החמצון וסוכן הפחתה בחום.
לכן, לכל מקורות הזרם הכימי יש שתי אלקטרודות:
-
האנודה עליה מתרחשת חמצון;
-
קתודה, מבצעת את שיקום החומר.
אלקטרודות במרחק ממוקמות בכלי עם אלקטרוליט - חומר המוליך זרם חשמלי עקב תהליכי ניתוק המדיום ליונים.
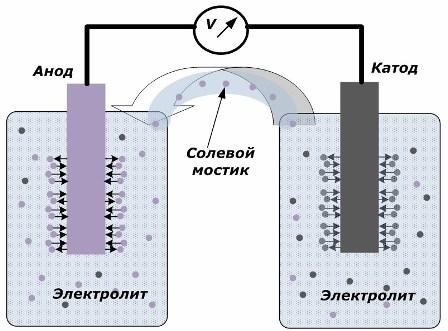
העיקרון של המרת אנרגיה כימית לאנרגיה חשמלית
באיור נראה כי האלקטרודות ממוקמות בכלי נפרד המחוברים באמצעות גשר מלח דרכו נוצרת תנועת יונים לאורך המעגל הפנימי. כאשר המעגלים החיצוניים והפנימיים פתוחים, שני תהליכים מתרחשים על האלקטרודות: מעבר של יוני מהמתכת של האלקטרודה לאלקטרוליט ומעבר של יונים מהאלקטרוליט לסריג הגביש של האלקטרודות.
קצב הזרימה של תהליכים אלה זהה ופוטנציאל המתח של סימנים הפוכים נצבר על כל אלקטרודה. אם הם מחוברים דרך גשר מלח ומופעל עומס, יתרחש מעגל חשמלי. זרם פנימי נוצר על ידי תנועת יונים בין האלקטרודות דרך האלקטרוליט וגשר המלח. תנועת אלקטרונים לאורך המעגל החיצוני בכיוון מהאנודה לקתודה.
כמעט כל תגובות ה- redox מלוות בייצור חשמל. אך ערכו תלוי בגורמים רבים, כולל הנפחים וההמונים של הכימיקלים המשמשים, החומרים המשמשים לייצור האלקטרודות, כמו אלקטרוליט, ריכוז יונים, תכנון.
השימוש הנפוץ ביותר במקורות זרם כימי מודרני הם:
-
לחומר האנודה (חומר מקטין) - אבץ (Zn), עופרת (Pb), קדמיום (Cd) וכמה מתכות אחרות;
-
לחומר הקתודה (מחמצן) - תחמוצת עופרת PbO2, תחמוצת מנגן MnO2, ניקל הידרוקסיד NiOOH ואחרים;
-
אלקטרוליטים על בסיס פתרונות של חומצות, אלקליות או מלחים.
שיטות סיווג
ניתן לעשות שימוש חוזר בחלק אחד ממקורות הכוח הכימיים ואילו החלק השני אינו יכול לעשות זאת. עיקרון זה נלקח כבסיס לסיווגם.
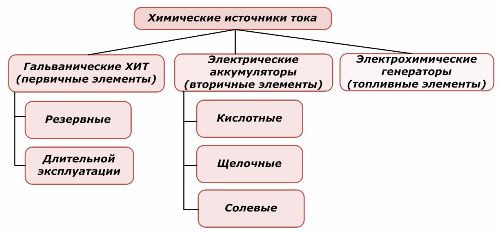
סיווג יסודות כימיים
כוח חשמל תאים גלווניים, תלוי בעיצוב, מגיע ל -1.2 1.5 1.5 וולט. כדי להשיג ערכים גדולים הם משולבים לסוללות, מתחברים בסדרה. כאשר הסוללות מחוברות במקביל, הזרם והעוצמה גדלים.
מקובל כי מקורות זרם כימיים ראשוניים אינם תומכים בטעינה מחדש, אם כי ליתר דיוק ניתן לנסח עמדה זו אחרת: יישומה אינו בר ביצוע כלכלי.
מקורות זרם כימי ראשיים מיותרים מאוחסנים במצב בו האלקטרוליט מבודד מהאלקטרודות. זה מבטל את התרחשות תגובת ה- redox ומבטיח מוכנות לשימוש. הם אינם משתמשים שוב. חיי המדף של מקורות כוח כימיים לגיבוי מוגבלים ל-10-15 שנים.
הסוללות נטענות בהצלחה על ידי יישום של אנרגיה חשמלית חיצונית. בשל תכונה זו, הם נקראים מקורות זרם משניים. הם מסוגלים לעמוד במאות ואלפי מחזורי פריקת טעינה.ה- EMF של הסוללה יכול להיות בטווח של 1.0 ÷ 1.5 וולט. הם גם משולבים לסוללות.
גנרטורים אלקטרוכימיים עובדים על העיקרון של תאים גלווניים, אך הם נושאים חומרים מבחוץ כדי לבצע תגובה אלקטרוכימית, וכל המוצרים המשוחררים מוציאים מהאלקטרוליט. זה מאפשר לך לארגן תהליך רציף.
מאפייני הביצועים העיקריים של מקורות כוח כימיים
1. המתח על פני מסופים פתוחים
בהתאם לעיצוב, מקור יחיד יכול ליצור הבדל פוטנציאלי מסוים בלבד. לשימוש במכשירים חשמליים הם משולבים לסוללות.
2. קיבולת ספציפית
למשך זמן מסוים (בשעות) מקור זרם כימי אחד יכול לייצר כמות מוגבלת של זרם (באמפר), המיוחסים ליחידת משקל או נפח.
3. צפיפות כוח
זה מאפיין את היכולת של יחידת משקל או נפח של מקור זרם כימי לייצר כוח שנוצר על ידי תוצר של מתח על ידי חוזק זרם.
4. משך הפעולה
פרמטר זה נקרא גם תאריך התפוגה.
5. הערך של זרמי פריקה עצמית
תהליכים צדדיים אלה של תגובות אלקטרוכימיות מובילים לצריכת המסה הפעילה של היסודות, גורמים לקורוזיה ומפחיתים את הקיבולת הספציפית.
6. מחיר מוצר
תלוי בעיצוב, בחומרים המשמשים ובמספר גורמים אחרים.
מקורות הזרם הכימי הטובים ביותר הם אלה עם ערכים גבוהים של ארבעת הפרמטרים הראשונים, והפריקה העצמית והעלות נמוכים.
עקרונות טעינת סוללה
בין מקורות זרם כימיים משניים הם צוברים פופולריות רבה. דגמי ליתיום יון, שהתרגלו לרוב להעברת מכשירים אלקטרוניים. הם משתמשים ב- LiMO2 (M Co, Ni, Mn) כחומר של האלקטרודה החיובית, וגרפיט כאלקטרודה השלילית.
כאשר טעונים, יוני ליתיום מהאנרגיה החיצונית המופעלת משתחררים ממתכת הקתודה, עוברים דרך האלקטרוליט וחודרים לחלל שבין שכבות הגרפיט, המצטברים שם.
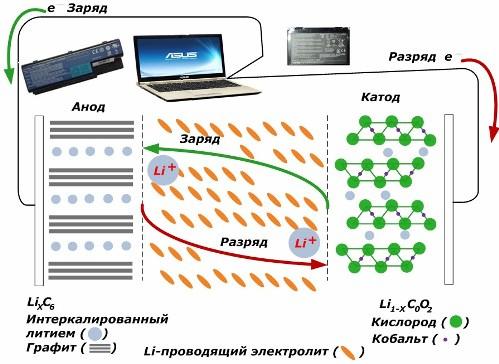
כאשר האנרגיה מטען נעדר והעומס מחובר לאלקטרודות ואז יוני ליתיום באלקטרוליט נעים בכיוון ההפוך.
אם הטעינה והפריקה לא מתבצעות, האנרגיה בסוללה לא נצרכת, אלא מאוחסנת. אך כמותו מוגבלת על ידי תכונות החומרים המשמשים. לדוגמה, בסוללות ליתיום-יון, הקיבולת החשמלית הספציפית היא 130 150 150 mAh / g. זה מוגבל על ידי המאפיינים של חומר האנודה. עבור גרפיט, הקיבולת גבוהה פי שתיים.
מדענים מחפשים כעת דרכים להגדיל את קיבולת הסוללה, ובוחנים את האפשרות להשתמש בתגובה כימית בין ליתיום וחמצן באוויר. לשם כך, עיצובים מפותחים עם קתודה אווירית ולא מתכלה, המשמשים בסוללות נפרדות. שיטה זו יכולה להגדיל את צפיפות האנרגיה עד פי 10.
הפעלת מקורות זרם כימי דורשת ידע יסודות הנדסת חשמל, אלקטרוכימיה, מדעי חומרים ופיזיקה של מצב מוצק.
ראה גם באתר elektrohomepro.com
:
