קטגוריות: חשמלאים מתחילים, חשמלאי תעשייתי
מספר צפיות: 37528
הערות לכתבה: 0
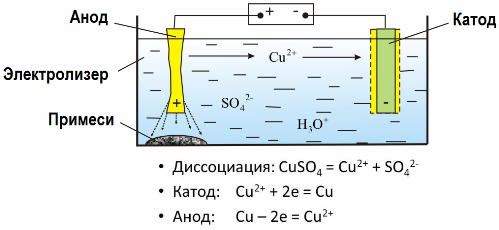
היישום המעשי של אלקטרוליזה
כאשר זרם חשמלי עובר דרך תמיסה או התכה של אלקטרוליט, הממסים או חומרים אחרים שהם תוצר של תגובות משניות על האלקטרודות משתחררים על האלקטרודות. תהליך פיזיוכימי זה נקרא אלקטרוליזה.
תמצית האלקטרוליזה
בשדה החשמלי שנוצר על ידי האלקטרודות, היונים בנוזל המוליך מגיעים בתנועה מסודרת. האלקטרודה השלילית היא הקתודה, החיובית היא האנודה.
יונים שליליים הנקראים אניונים (יונים מקבוצת ההידרוקסיל ומשקעי חומצה) ממהרים לאנודה, ויונים חיוביים הנקראים קטיונים (מימן, מתכת, יוני אמוניום וכו ') ממהרים לקתודה.
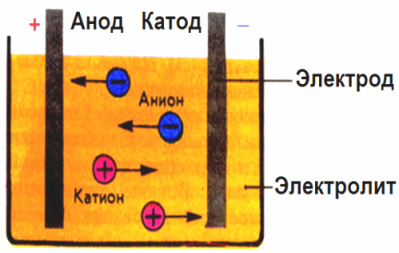
תהליך הפחתת חמצון מתרחש באלקטרודות: הפחתה אלקטרוכימית של חלקיקים (אטומים, מולקולות, קטיונים) מתרחשת בקתודה, וחמצון אלקטרוכימי של חלקיקים (אטומים, מולקולות, אניונים) מתרחש באנודה. תגובות דיסוציאציה באלקטרוליט הן תגובות ראשוניות, ותגובות שמתרחשות ישירות באלקטרודות נקראות משניות.
חוקי האלקטרוליזה של פאראדיי
הפרדת תגובות האלקטרוליזה לראשוניות ומשניות סייעה למייקל פאראדיי לבסס את חוקי האלקטרוליזה:
-
החוק הראשון של האלקטרוליזה של פאראדיי: מסת החומר המופקדת על האלקטרודה במהלך האלקטרוליזה עומדת ביחס ישיר לכמות החשמל המועברת לאלקטרודה זו. בכמות החשמל הכוונה למטען חשמלי, הנמדד ככלל בתליונים.
-
החוק השני של האלקטרוליזה של פאראדיי: עבור כמות נתונה של חשמל (מטען חשמלי), מסת המרכיב הכימי המופקד על האלקטרודה עומדת ביחס ישר למסה המקבילה של היסוד. המסה המקבילה של חומר היא המסה הטוחנית שלו המחולקת במספר שלם, תלוי בתגובה הכימית בה מעורב החומר.
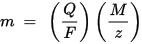
m הוא המסה של החומר המופקד על האלקטרודה, Q הוא המטען החשמלי הכולל שעובר בחומר F = 96,485.33 (83) C mol - 1 הוא קבוע פאראדיי, M הוא המסה הטוחנית של החומר (לדוגמא, המסה הטוחנית של מים H2O = 18 גרם / mol), z הוא מספר הערכיות של יונים של חומר (מספר האלקטרונים ליון).
שימו לב ש- M / z הוא המסה המקבילה של החומר המשוחרר. עבור החוק הפרדאי הראשון, M, F ו- z הם קבועים, כך שככל שהערך של Q גדול יותר, כך הערך של m גדול יותר. עבור החוק השני של פאראדיי, Q, F ו- z הם קבועים, כך שככל שהערך של M / z (מסה שווה ערך) גדול יותר, כך הערך של m גדול יותר.
אלקטרוליזה נמצאת כיום בשימוש נרחב בתעשייה ובטכנולוגיה. לדוגמא, אלקטרוליזה משמשת כאחת מהשיטות היעילות ביותר לייצור תעשייתי של מימן, מי חמצן, דו תחמוצת המנגן, אלומיניום, נתרן, מגנזיום, סידן וחומרים אחרים. אלקטרוליזה משמשת לטיפול בשפכים, אלקטרוליטי, אלקטרוליטי ולבסוף במקורות זרם כימי. אבל קודם דברים ראשונים.
השגת מתכות טהורות מעפרות באמצעות אלקטרוליזה
בזכות האלקטרוליזה, מתכות רבות מופקות מעפרות ועובדות להמשך עיבוד. לכן, כאשר עפרות או עפרות מועשרות - תרכיז - מטופלים בחומרים ריאגנטים, המתכת עוברת לתמיסה, ואז המתכת מופקת מהפתרון על ידי עקירה אלקטרונית. מתכת טהורה משוחררת במקביל בקתודה. בדרך זו מקבלים אבץ, נחושת, קדמיום.
מתכות עוברות הגדרה אלקטרונית על מנת לחסל זיהומים ולהמיר את הזיהומים הכלולים לצורה הנוחה להמשך עיבוד. המתכת שיש לנקות יצוקה בצורה של צלחות, ולוחות אלה משמשים כאנודים באלקטרוליזה.
כאשר הזרם עובר, המתכת של האנודה מתמוססת, עוברת בצורה של קטיונים לתמיסה, ואז הקטיונים משוחררים בקתודה ויוצרים משקע של מתכת טהורה. הזיהומים של האנודה אינם מתמוססים - הם משקעים עם גרסת האנודה או עוברים לאלקטרוליט, משם הם מוסרים ברציפות או מעת לעת.
קחו כדוגמה הגדרת אלקטרודות נחושת. המרכיב העיקרי בתמיסה - סולפט נחושת - המלח הנפוץ והזול ביותר של מתכת זו. לפיתרון מוליכות חשמלית נמוכה. כדי להגדיל אותה, חומצה גופרתית מתווספת לאלקטרוליט.
בנוסף, מוחדרים לפתרון כמויות קטנות של תוספים כדי להקל על היווצרות משקעים מתכתיים קומפקטיים. באופן כללי, נחושת, ניקל, עופרת, פח, כסף וזהב נתונים לזיקוק אלקטרוליטי.
טיפול בשפכים אלקטרוליזה
אלקטרוליזה משמשת לטיפול בשפכים (תהליכים של קרישת אלקטרודות, עקירות אלקטרודות והפרעה אלקטרוליטית). שיטת הניקוי האלקטרוכימית היא אחת הנפוצות ביותר. לצורך אלקטרוליזה משתמשים באנודות לא מסיסות (מגנטיט, תחמוצת עופרת, גרפיט, מנגן המופקדים על בסיס טיטניום) או מסיסים (אלומיניום, ברזל).
שיטה זו משמשת לבידוד חומרים רעילים ואורגניים אורגניים ממים. לדוגמא, צינורות נחושת מנקים בהיקף בעזרת תמיסה של חומצה גופרתית, ואז יש לנקות את השפכים התעשייתיים באמצעות אלקטרוליזה בעזרת אנודה בלתי מסיסה. נחושת משוחררת בקתודה, שבה ניתן להשתמש שוב באותו מפעל.
שפכים אלקליין מטוהרים באמצעות אלקטרוליזה מתרכובות ציאניד. על מנת להאיץ את חמצון הציאנידים, להגביר את המוליכות החשמלית ולחסוך באנרגיה, משתמשים בתוסף בצורת נתרן כלורי במים.
אלקטרוליזה מתבצעת בעזרת אנודה גרפיט וקתודה מפלדה. ציאנידים נהרסים במהלך חמצון אלקטרוכימי וכלור שמשתחרר על האנודה. היעילות של ניקוי כזה היא קרוב ל 100%.
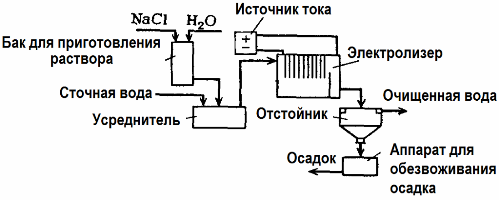
בנוסף לניקוי אלקטרוכימי ישיר, ניתן לכלול אותו בתהליך האלקטרוליזה קרישה. למעט תוספת מלחים, אלקטרוליזה מתבצעת בעזרת אנודות אלומיניום או ברזל מסיסות. ואז לא רק המזהמים באנודה נהרסים, אלא שהאנודה עצמה מתמוססת. נוצרות תרכובות מפוזרות אקטיביות המקרשות (מעבות) מזהמים מפוזרים קולואידים.
שיטה זו יעילה לטיפול בשפכים משומנים, מוצרי שמן, צבעים, שמנים, חומרים רדיואקטיביים וכו '. זה נקרא אלקטרואקרואציה.
אלקטרוליטי
אלקטרוליטי הוא התמצית האלקטרוליטית של מתכות מסוימות על מנת להגן על מוצרים מפני קורוזיה וכדי להעניק להם מראה אסתטי מתאים (הציפוי נעשה בכרום, ניקל, כסף, זהב, פלטינה וכו '). הדבר מנוקה ביסודיות, משומן, ומשמש כקתודה באמבט אלקטרוליטי בו מוזגים תמיסת מלח של המתכת איתה יש צורך לציפוי המוצר.
צלחת מאותה מתכת משמשת לאנודה. ככלל, משתמשים בזוג לוחות אנודה, והנושא שיש לגלוון ממוקם ביניהם.
אלקטרופורמינג
אלקטרוליטי - הצבת מתכת על פני גופים שונים לשחזור צורותיהם: תבניות ליציקת חלקים, פסלים, קלישאות מודפסות וכו '.

הצבה גלוונית של מתכת על פני חפץ אפשרית רק כאשר משטח זה או האובייקט כולו הם מוליך זרם חשמלי, ולכן רצוי להשתמש במתכות לייצור דגמים או צורות. מתכות ניתנות למיזוג המתאימות ביותר למטרה זו: עופרת, פח, נמלים, סגסוגת עץ.
מתכות אלה רכות, מעובדות בקלות בעזרת כלים לעיבוד מתכת, נחקקות היטב ויצוקות. לאחר בניית השכבה הגלוונית והגמר, מתכת העובש מריחה מהמוצר המוגמר.
עם זאת, ההזדמנויות הגדולות ביותר לייצור דגמים מיוצגות עדיין על ידי חומרים דיאלקטריים. למתכת דגמים כאלה, יש צורך לתת מוליכות חשמלית לפני השטח שלהם. הצלחה או כישלון בסופו של דבר תלויים בעיקר באיכות השכבה המוליכה. ניתן ליישם שכבה זו באחת משלוש דרכים.
הדרך הנפוצה ביותר היא גרפיטיזציה, הוא מתאים לדגמי פלסטלינה וחומרים אחרים המאפשרים ליטוש גרפיט על פני השטח.
הטריק הבא הוא ברונזה, השיטה טובה לדגמים בעלי צורה מורכבת יחסית, עבור חומרים שונים, אולם בגלל עובי שכבת הברונזה, העברת הפרטים הקטנים מעוותת במקצת.
ולבסוף הכסףמתאים בכל המקרים, אך חשוב במיוחד לדגמים שבירים עם צורה מורכבת מאוד - צמחים, חרקים וכו '.
מקורות זרם כימי
כמו כן, אלקטרוליזה היא התהליך העיקרי שבגללו פועלים מקורות הזרם הכימי המודרניים ביותר, כמו סוללות ומצברים. יש שתי אלקטרודות במגע עם האלקטרוליט.
נוצר הבדל פוטנציאלי בין האלקטרודות - כוח אלקטרומוטיבי המתאים לאנרגיה החופשית של תגובת redox. ראה כאן לפרטים נוספים: מקורות כימיים לזרם חשמלי
סוללת לימון (לחץ על התמונה להגדלה)
פעולתם של מקורות זרם כימי מבוססת על התרחשותם של תהליכים המופרדים במרחב עם מעגל חיצוני סגור: על האנודה השלילית, החומר המצמצם מתחמצן, האלקטרונים החופשיים הנוצרים עוברים דרך המעגל החיצוני לקתודה החיובית, ויוצרים זרם פריקה, שם הם משתתפים בתגובת הפחתת החמצון. לפיכך, זרימת האלקטרונים טעונים באופן שלילי לאורך המעגל החיצוני עוברת מהאנודה לקתודה, כלומר מהאלקטרודה השלילית לזו החיובית.
ראה גם באתר elektrohomepro.com
: